Le Groupe d’étude canadien sur les soins de santé préventifs recommande de ne pas dépister les adultes atteints de reflux gastro-œsophagien (RGO) chronique pour l’adénocarcinome œsophagien et ses précurseurs (œsophage de Barrett ou dysplasie), parce que le dépistage n’apporte aucun bénéfice probant, qu’il implique des préjudices incertains, une mobilisation importante des ressources, et que les valeurs et préférences des patients face à ce dépistage sont variables.
Une seule étude de cohorte rétrospective (très faible certitude des données probantes) a révélé que le dépistage chez les patients atteints de RGO chronique a identifié un plus grand nombre de cas d’adénocarcinome œsophagien à un stade précoce, mais n’a mis en évidence aucune différence sur le plan de la survie à long terme (mortalité de toute cause).
L’acceptabilité du dépistage a été variable en raison des valeurs et préférences individuelles; certaines personnes tenaient au dépistage en raison de facteurs de risque individuels et familiaux, de convictions personnelles ou d’une crainte de passer à côté d’un diagnostic précoce, tandis que d’autres s’inquiétaient du caractère invasif du dépistage et des risques associés.
Cette ligne directrice sur le dépistage ne s’applique pas aux personnes qui manifestent des symptômes d’alarme susceptibles d’être causés par l’adénocarcinome œsophagien (p. ex., dysphagie, odynophagie, vomissements récurrents, perte de poids inexpliquée, anémie, inappétence ou saignement gastro-intestinal) ni aux personnes qui ont un diagnostic d’œsophage de Barrett (avec ou sans dysplasie).
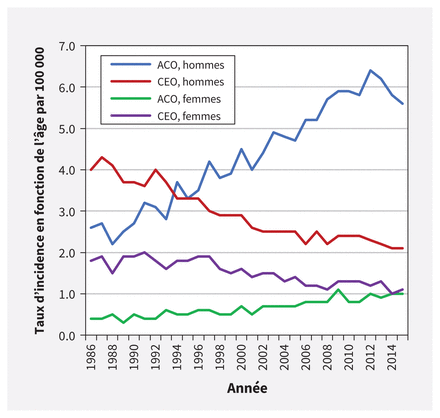
En 2019, on a estimé à 6 par 100 000 le nombre de nouveaux cas de cancer de l’œsophage diagnostiqués chez les Canadiens1. Évalué à 15 %, le taux de survie net à 5 ans est parmi les plus faibles de tous les pronostics de cancer1. Les hommes présentent une incidence plus élevée que les femmes, avec environ 9 cas contre 2 par 100 000, respectivement1. L’adénocarcinome est le type le plus fréquent de cancer de l’œsophage au Canada, suivi du carcinome épidermoïde2. L’incidence s’est modifiée depuis une quarantaine d’années, avec des taux d’adénocarcinome en hausse et des taux de carcinome épidermoïde en baisse (figure 1)3. Ce changement peut être dû à une augmentation des facteurs de risque d’adénocarcinome (p. ex., reflux gastro-œsophagien, obésité) et à une diminution des facteurs de risque de carcinome épidermoïde (p. ex., tabagisme)2. Cette ligne directrice se concentre donc sur le dépistage de l’adénocarcinome œsophagien.
Taux d’incidence selon l’âge* de l’adénocarcinome œsophagien (ACO) et du carcinome épidermoïde œsophagien (CEO), tous âges, Canada (sauf le Québec)†, de 1986 à 2015. Source des données : Bases de données du Registre canadien du cancer et du Système national de déclaration des cas de cancer de Statistique Canada. Analysé par : le Centre de surveillance et de recherche appliquée de l’Agence de la santé publique du Canada. *Standardisé selon l’âge pour la population canadienne de 2011; voir annexe 1F pour les codes topographiques et morphologiques du cancer œsophagien inclus. †Les données pour le Québec ont été exclues parce qu’elles n’étaient pas disponibles pour toutes les périodes.
Les plus importants facteurs de risque pour l’adénocarcinome œsophagien sont : certaines conditions précancéreuses (p. ex., œsophage de Barrett, dysplasie œsophagienne), âge plus avancé (≥ 50 ans), reflux gastro-œsophagien (RGO), sexe masculin, antécédents familiaux, race ou ethnicité blanche, obésité abdominale et tabagisme4–10.
Le reflux gastro-œsophagien (définition internationale de Montréal11) est un problème répandu, caractérisé par une remontée du contenu gastrique (régurgitation acide) qui cause des symptômes désagréables (p. ex., brûlures d’estomac, aigreurs). Il faut distinguer le RGO de la dyspepsie, qui est un syndrome principalement caractérisé par une douleur épigastrique d’une durée d’au moins 1 mois12. En Amérique du Nord et en Europe, la prévalence du RGO (basée sur une manifestation hebdomadaire des symptômes) toucherait de 10 % à 20 % de la population selon les estimations13,14.
Le reflux gastro-œsophagien multiplie par 5 à 7 la probabilité de souffrir d’un adénocarcinome œsophagien (35 cas contre 7 par 100 000 hommes à l’âge de 60 ans); 60 % des patients atteints de ce cancer disent avoir souffert de RGO15–17. Par contre, la majorité des gens qui souffrent de RGO chronique ne développent pas d’adénocarcinome de l’œsophage, et il est toujours difficile de prédire la progression18. Un modèle de Markov appliqué à des personnes de race blanche, non hispaniques, âgées de 60 ans qui présentaient des symptômes de RGO au moins toutes les semaines a estimé l’incidence de l’adénocarcinome œsophagien à 35 par 100 000 années-personnes chez les hommes et à 4 par 100 000 années-personnes chez les femmes17.
L’œsophage de Barrett est une adaptation métaplasique des cellules de l’œsophage où une muqueuse de type intestinal remplace la muqueuse squameuse normale19,20. Environ de 5 % à 15 % des patients atteints de RGO développent un œsophage de Barrett, contre 1 % à 2 % de la population générale10. La dysplasie peut se manifester de manière indépendante, mais elle est plus fréquente chez les gens qui ont un œsophage de Barrett21. On croit que l’histoire naturelle de l’adénocarcinome œsophagien suit une progression séquentielle allant du RGO à l’œsophage de Barrett, vers une dysplasie de bas grade, puis de haut grade5,22,23. Le risque de souffrir d’un adénocarcinome œsophagien consécutif à un œsophage de Barrett augmente d’un niveau de 0,3 % par année en l’absence de dysplasie, à 0,5 % en présence de dysplasie de bas grade et à 6 % en présence de dysplasie de haut grade24–26.
Environ 93 % des diagnostics d’adénocarcinome œsophagien sont posés lors de l’investigation de patients qui présentent des symptômes d’alarme, tels dysphagie, odynophagie, vomissements récurrents, perte de poids inexpliquée, anémie, inappétence ou saignements gastro-intestinaux, qui peuvent être associés à un adénocarcinome de stade avancé7,27–29.
Le Groupe d’étude canadien sur les soins de santé préventifs a voulu savoir si le dépistage endoscopique des patients atteints de RGO chronique sans symptômes d’alarme permettait de dépister le cancer à un stade plus précoce, d’identifier des conditions précancéreuses traitables (œsophage de Barrett, dysplasie), de réduire la progression vers un adénocarcinome œsophagien ou de réduire la mortalité.
Portée
Cette ligne directrice s’adresse aux professionnels en soins primaires, c’est-à-dire, aux professionnels de la santé qui offrent l’accès à des soins complets et coordonnés sur une base continue, et représentent le premier point de contact avec le système de santé30. La population cible se compose d’adultes atteints de RGO chronique et exclut ceux qui ont des symptômes d’alarme ou qui ont déjà un diagnostic d’œsophage de Barrett (avec ou sans dysplasie).
Le Groupe d’étude canadien a initialement défini le RGO chronique comme suit : symptômes de RGO d’une durée de 12 mois ou plus (sans fréquence spécifique) ou utilisation d’un inhibiteur de la pompe à protons (ou autre pharmacothérapie) pour traiter le RGO d’une durée de 12 mois ou plus31,32. Toutefois, nous avons ensuite élargi la définition afin d’inclure dans la revue des données probantes pour la ligne directrice toute étude sur le « RGO chronique » basée sur les critères des auteurs des études33–35.
Recommandation
Nous recommandons de ne pas faire de dépistage de l’adénocarcinome œsophagien ou de ses précurseurs (œsophage de Barrett ou dysplasie) chez les adultes (≥ 18 ans) atteints de RGO chronique (forte recommandation; très faible certitude des données probantes).
Cette recommandation ne s’applique pas aux personnes qui manifestent des symptômes d’alarme ou qui ont déjà reçu un diagnostic d’œsophage de Barrett (avec ou sans dysplasie).
Même si des facteurs de risque tels que âge (≥ 50 ans), sexe masculin, antécédents familiaux, race ou ethnicité blanche, obésité abdominale et tabagisme peuvent accroître le risque d’adénocarcinome œsophagien, les essais et études de cohorte pertinents n’incluaient pas suffisamment de données de chacune de ces catégories pour appuyer une modification de notre recommandation quant à un dépistage en fonction de ces facteurs, pris ensemble ou séparément (annexe 1C, accessible en anglais ici : www.cmaj.ca/lookup/suppl/doi:10.1503/cmaj.190814/-/DC2.)33,35. Voir encadré no 1 pour les définitions utilisées dans les lignes directrices du Groupe d’étude canadien concernant les degrés de certitude des données probantes et la force des recommandations36.
Classification des recommandations36
Les recommandations sont classifiées selon le système GRADE (Grading of Recommendations Assessment, Development and Evaluation system)37. Qu’une recommandation soit forte ou conditionnelle* dépend de facteurs tels que la certitude des effets d’une intervention, y compris leur ampleur, de même que des estimations de la façon dont les patients évaluent et priorisent les résultats, de la variabilité de ces estimations et d’une utilisation judicieuse des ressources.
Recommandations fortes
Les recommandations fortes sont celles à propos desquelles le Groupe d’étude canadien sur les soins de santé préventifs considère que les effets escomptés d’une intervention en surpassent les conséquences indésirables (recommandation forte à l’appui de l’intervention) ou que les conséquences indésirables d’une intervention en surpassent les effets escomptés (recommandation forte à l’encontre de l’intervention). Une recommandation forte suppose que les intérêts de la plupart des individus seront mieux servis par la mesure recommandée.
Les recommandations fortes se fondent normalement sur des données probantes de grande certitude (c.-à-d., grande fiabilité de l’effet estimé d’une intervention). Les recommandations fortes peuvent préconiser une intervention (degré de confiance élevé quant aux bénéfices escomptés) ou la déconseiller (degré de confiance élevé quant à la probabilité de préjudices). Toutefois, il y a des circonstances où une forte recommandation peut être envisagée en fonction de données probantes de faible ou de très faible certitude, ou en l’absence de données probantes ou si elles sont de faible certitude quant à un bénéfice.
Lorsqu’il y a absence de données probantes pour croire qu’il y a un bénéfice à appliquer un nouveau service de prévention ou lorsqu’une conclusion quant à un bénéfice possible requiert un degré élevé de spéculation quant aux liens avec des données de faible certitude, mais qu’il y a une forte certitude que certains patients pourraient subir un préjudice ou que les ressources précieuses du système de santé pourraient être utilisées à mauvais escient, le Groupe d’étude canadien peut formuler une forte recommandation à l’encontre de l’application dudit service. Ceci concorde avec l’approche GRADE38, selon laquelle de fortes recommandations sont parfois formulées sur la base de preuves de faible certitude, alliées à une forte certitude quant à des préjudices ou à une utilisation indue des ressources, et compte tenu de la valeur qu’accorde le Groupe d’étude canadien à l’utilisation judicieuse des ressources en soins primaires.
Recommandations conditionnelles
Les recommandations conditionnelles sont celles à propos desquelles les effets escomptés surpassent probablement les conséquences indésirables (recommandation conditionnelle en faveur d’une intervention) ou les conséquences indésirables surpassent probablement les effets escomptés (recommandation conditionnelle à l’encontre d’une intervention), mais une incertitude marquée existe. Les recommandations conditionnelles sont formulées lorsque la certitude des données probantes est plus faible, lorsque la frontière entre effets recherchés et conséquences indésirables est mince et lorsque l’équilibre dépend des valeurs et préférences des patients, ou lorsqu’il y a une forte variabilité entre les valeurs et les préférences des patients. Les cas où le rapport coût:bénéfice est ambigu, où les parties prenantes clés ne s’entendent pas sur l’acceptabilité ou la faisabilité de l’intervention, et où l’effet sur l’équité en matière de santé est indéterminé, conduiront probablement à une recommandation conditionnelle.
Dans certains cas où on formule une recommandation conditionnelle concernant une intervention, les cliniciens sont encouragés à impliquer leurs patients dans un processus de prise de décision partagée, à reconnaître que différents choix seront appropriés selon les patients et à aider chacun d’entre eux à prendre une décision relative à une intervention qui est en accord avec ses valeurs et ses préférences. Cela exige des cliniciens qu’ils reconnaissent que différents choix peuvent être appropriés selon les patients et que ces décisions doivent concorder avec les valeurs et préférences de ces derniers. Des outils d’application des connaissances sont disponibles sur le site Web du Groupe d’étude canadien (www.canadiantaskforce.ca) pour promouvoir une prise de décision fondée sur des données probantes et en accord avec les priorités des individus.
Les données probantes sont jugées de certitude forte, modérée, faible ou très faible, selon la probabilité que des recherches plus approfondies modifient le degré de confiance du Groupe d’étude canadien à l’endroit de l’effet attendu de l’intervention.
* Le Groupe d’étude canadien utilisait autrefois le terme « recommandation faible », mais l’a remplacé par le terme « recommandation conditionnelle » pour plus de clarté et pour faciliter l’application des recommandations, en s’inspirant des commentaires formulés par les médecins utilisateurs des connaissances. Ce changement a notamment été motivé par l’importance que le Groupe d’étude canadien accorde au processus de prise de décision partagée et à la nécessité de préciser si l’application d’une recommandation dépend de certaines circonstances, telles que les valeurs des patients, la disponibilité des ressources ou d’autres facteurs contextuels.
Dépistage
Une revue systématique a recensé 2 études de cohorte rétrospectives basées sur des dossiers médicaux électroniques qui ont évalué l’efficacité (bénéfices et préjudices) du dépistage par rapport à l’absence de dépistage chez les patients atteints de RGO chronique39,40. La gravité ou la durée du RGO n’étaient pas définies dans ces études. L’étude de Rubenstein et ses collaborateurs portait sur 155 patients porteurs d’un diagnostic d’adénocarcinome œsophagien et ayant subi (n = 25) ou non (n = 130) une œsophagogastroduodénoscopie au cours des 5 années précédentes. Pour ce qui est des bénéfices potentiels, cette étude n’a révélé aucune amélioration statistiquement significative de la survie à long terme (mortalité de toute cause) (rapport de risque [RR] ajusté, 0,93, intervalle de confiance [IC] de 95 %, 0,58 à 1,50) (très faible certitude des données probantes)39. La même étude a révélé un effet absolu statistiquement significatif chez les patients qui avaient subi une œsophagogastroduodénoscopie : 156 de plus par 1000 (IC de 95 %, 5 à 486 de plus par 1000) (très faible certitude des données probantes) ont reçu un diagnostic d’adénocarcinome œsophagien de stade moins avancé (stade 1 c. stades 2–4) (tableau 1). La deuxième étude de cohorte rétrospective disposait de données insuffisantes pour déterminer si le dépistage permettait un diagnostic à un stade moins avancé ou une baisse de la mortalité40. Les 2 études présentaient des données insuffisantes pour procéder à des analyses de sous-groupes en fonction des facteurs de risque (annexe 1C)33,35. Aucune des études incluses n’a rapporté ou fourni de données concernant les autres issues cliniques d’intérêt identifiées (c.-à-d., mortalité par cause spécifique, qualité de vie, interventions médicales supplémentaires ou surdiagnostic)33,35. Cinq essais randomisés et contrôlés41–45 (ERC) et 1 étude de cohorte46 ont comparé différentes modalités de dépistage de l’œsophage de Barrett, dont l’œsophagogastroduodénoscopie sous sédation, l’œsophagoscopie transnasale sans sédation, l’œsophagoscopie par vidéocapsule (avalée) et l’œsophagoscopie transorale sans sédation33,35. Lorsqu’elle était rapportée, la définition du RGO variait d’une étude à l’autre; certaines études n’ont pas mentionné la durée du RGO42,45,46 ou l’utilisation des inhibiteurs de la pompe de protons 42,45; et aucune n’a utilisé la définition de Montréal11. On n’a noté aucune différence statistiquement significative quant aux taux de dépistage de l’œsophage de Barrett confirmé ou de la dysplasie entre les différentes modalités, et aucun cas d’adénocarcinome œsophagien n’a été dépisté (très faible certitude des données probantes)33,35.
sommaire des issues cliniques cernant le dépistage c. l’absence de dépistage de l’adénocarcinome œsophagien chez les personnes atteintes de reflux gastro-œsophagien chronique
Quatre ERC ont évalué les préjudices causés par le dépistage41,43–45. Les données probantes de 2 essais qui ont comparé l’œsophagogastroduodénoscopie sous sédation à l’œsophagoscopie transnasale sans sédation (n = 209)43, et l’intervention transnasale sans sédation à l’œsophagogastroduodénoscopie transorale sans sédation (n = 59)45 ont fait état d’un événement indésirable grave (après l’endoscopie transnasale)33,35. Dans 3 ERC, l’œsophagoscopie transnasale sans sédation a été associée à une augmentation statistiquement significative de l’anxiété (préjudice) comparativement à l’œsophagogastroduodénoscopie sous sédation (durant l’intervention) ou l’œsophagoscopie par vidéocapsule (avant et durant l’intervention) (très faible certitude des données probantes)41,43,44 (tableau 2). Toutefois, le léger inconfort additionnel a semblé bien toléré, étant donné que 70 % à 95 % des participants ont déclaré qu’ils se soumettraient de nouveau à l’intervention41–45.
Sommaire des issues cliniques concernant les préjudices avant et durant le dépistage de l’adénocarcinome œsophagien chez les personnes atteintes de reflux gastro-œsophagien chronique (selon la modalité de dépistage)
Traitement
Étant donné le peu de données probantes directes disponibles sur l’efficacité du dépistage, le Groupe d’étude canadien a aussi analysé les données probantes indirectes sur l’efficacité du traitement de l’œsophage de Barrett, de la dysplasie ou de l’adénocarcinome œsophagien de stade35,47. Cette analyse s’est attardée aux approches thérapeutiques endoscopiques, qui sont plus pertinentes pour les cancers découverts lors d’un dépistage (c.-à-d., à un stade précoce); cependant, l’œsophagectomie demeure le traitement standard pour le cancer de l’œsophage localisé qui a progressé au-delà des tout premiers stades5,48.
Pour ce qui est des bénéfices potentiels des traitements, les résultats montrent que le traitement photodynamique, l’ablation par radiofréquence et la résection muqueuse endoscopique de l’œsophage de Barrett (avec ou sans inhibiteurs de la pompe de protons) donnent lieu à une augmentation statistiquement significative de l’éradication ou de l’élimination de la dysplasie (très faible à faible certitude des données probantes) (annexe 1D)35,47. Une possible réduction de la progression vers l’adénocarcinome œsophagien a aussi été observée avec le traitement photodynamique (très faible à faible certitude des données probantes)35,47. Les résultats concernant la mortalité étaient très limités (taux d’événements de 0 à 3 par essai)35,47. Pour l’ensemble des issues cliniques, des données probantes de faible à très faible certitude soutiennent que ces traitements améliorent l’éradication ou l’élimination de la dysplasie, mais leur bénéfice au plan de la mortalité est inconnu.
Une évaluation des complications des traitements a révélé une augmentation statistiquement significative des sténoses et des rétrécissements de l’œsophage associée à la résection muqueuse endoscopique comparativement à l’ablation par radiofréquence (très faible certitude des données probantes) (annexe 1E)35,47. Comparativement à l’oméprazole seul, le traitement photodynamique plus oméprazole a donné lieu à une augmentation statistiquement significative de la formation de sténoses (très faible certitude des données probantes)35,47. Aucune donnée n’a porté sur les autres issues cliniques d’intérêt identifiées (qualité de vie, effets psychologiques des traitements, interventions médicales supplémentaires à la suite du traitement ou surdiagnostic)35,47.
Valeurs et préférences des patients
Une revue systématique des valeurs et préférences des patients34,35 n’a permis de trouver aucune donnée probante sur la façon dont les patients soupèsent les bénéfices et les préjudices associés au dépistage. Par contre, des données probantes sur les facteurs qui influent sur la décision de subir le dépistage (acceptabilité) ont été trouvées dans 3 études qui comparaient diverses stratégies de dépistage endoscopique (œsophagoscopie transnasale sans sédation41,45, œsophagoscopie par vidéocapsule [avalée]41, endoscopie perorale sans sédation45,49 et endoscopie sous sédation)49. Dans un essai, sur les 1210 participants sollicités, 52 % n’ont pas répondu à l’invitation, 32 % ont refusé le dépistage (sans justification), 1 % n’y étaient pas admissibles et 0,2 % ont invoqué une incapacité d’y participer41. Deux autres études ont fait état de taux de refus élevés (refus déclaré ou intentionnel) (45/105 patients, 43 %; 19/62 patients, 31 %) pour les raisons suivantes : anxiété, absence d’intérêt, crainte du réflexe nauséeux, refus de participer à une étude ou réticence vis-à-vis de la voie d’insertion transnasale45,49.
Des sondages et des groupes de discussion menés par l’équipe de l’application des connaissances en vue de cette ligne directrice ont révélé qu’en considérant le rapport préjudices:bénéfices, les participants qui souffraient de RGO chronique exprimaient un intérêt modéré pour le dépistage (valeur médiane = 6 sur 9, sur une échelle de 1 = refus catégorique à 9 = acceptation inconditionnelle)50. Pour plusieurs de ces répondants, des facteurs de risque individuels ou familiaux, des convictions personnelles ou la crainte de passer à côté d’un diagnostic précoce ont eu plus de poids que les craintes associées au dépistage (p. ex., caractère effractif et complications). Pour certains autres répondants, la faible certitude des données probantes et le risque perçu associé au dépistage auraient conduit à la décision de refuser le dépistage50. À partir de cet éventail d’observations tirées des essais et des groupes de discussion, les valeurs et les préférences relatives au dépistage ont été jugées variables.
Utilisation des ressources
Étant donné la très faible certitude des données et l’absence de données probantes montrant un bénéfice associé au dépistage, aucune évaluation économique ou revue systématique sur le rapport coût-efficacité n’ont été réalisées. Les coûts potentiels du dépistage incluent les frais médicaux, les dépenses des hôpitaux/cliniques et les analyses de biopsie51,52.
Faisabilité, acceptabilité, coût et équité
De l’avis du Groupe d’étude canadien, les enjeux de faisabilité et de coûts sont importants, étant donné que le RGO chronique est une maladie très répandue (10 %–20 % de la population canadienne)13,14. Des rapports canadiens montrent que les temps d’attente pour les endoscopies sont considérés comme trop longs et excèdent les objectifs recommandés53,54. L’application du dépistage augmenterait la demande et pourrait aggraver les problèmes d’équité en matière de santé, puisque les immigrants récents et les populations rurales ou éloignées, autochtones ou à faible revenu risqueraient de ne pas y avoir aussi facilement accès55,56. Étant donné l’incertitude des données et le manque de données probantes sur l’efficacité, nous sommes d’avis qu’il ne serait ni faisable ni acceptable de procéder au dépistage de tous les patients atteints de RGO, qui pourrait mobiliser à mauvais escient beaucoup de ressources en santé.
Justification
Globalement, le degré de certitude des données probantes était très faible. Une petite étude de cohorte rétrospective a comparé le dépistage à l’absence de dépistage et conclu que, même si les patients ayant déjà subi une œsophagogastroduodénoscopie étaient statistiquement plus susceptibles d’être atteints d’un adénocarcinome de stade moins avancé au moment du diagnostic, il n’y avait pas de différence statistiquement significative sur la survie (c.-à-d., absence de bénéfice)39. Un seul événement indésirable grave associé au dépistage a été signalé lors de 2 petits essais, qui comparaient des modalités de dépistage (très faible certitude des données probantes)33,35. Les valeurs et les préférences des patients étaient variables, puisque certains se disaient modérément intéressés par le dépistage (en fonction de leur évaluation des bénéfices et préjudices)50; toutefois, la participation réelle aux essais sur le dépistage a été faible34,35. De plus, le dépistage de tous les adultes qui souffrent de RGO chronique mobiliserait des ressources substantielles.
Certains traitements endoscopiques permettent d’éradiquer la dysplasie, mais la synthèse des revues systématiques sur ce type de données probantes indirectes a montré des degrés très variés de certitude des données probantes, allant de très faible à faible35,47. L’efficacité du traitement médical de l’œsophage de Barrett reste à confirmer.
Étant donné que nous n’avons observé qu’un stade statistiquement plus précoce au moment du diagnostic (dans une étude de cohorte rétrospective39), sans différence sur la survie ou d’autres issues cliniques importantes pour les patients, le Groupe d’étude canadien recommande de ne pas faire de dépistage. La recommandation est forte parce qu’en vertu de son cadre de référence pour passer des données probantes au libellé d’une décision, le Groupe d’étude canadien a accordé une valeur élevée aux ressources requises pour faire le dépistage chez tous les patients atteints de RGO à l’échelle du système, sans données probantes quant à un bénéfice (annexe 1B). Comme le mentionne une ligne directrice précédente36, lorsqu’il y a absence de données probantes pour croire qu’il y a un bénéfice à instaurer un nouveau service de prévention et qu’il y a une forte certitude que les ressources limitées du système de santé seraient dépensées, le Groupe d’étude canadien peut formuler une recommandation forte à l’encontre de l’application dudit service. Ceci concorde avec l’approche GRADE38, selon laquelle des recommandations fortes sont parfois formulées sur la base de données probantes de faible certitude, alliées à une forte certitude quant à des préjudices ou quant à une utilisation indue des ressources, compte tenu de la valeur qu’accorde le Groupe d’étude canadien à l’utilisation judicieuse des ressources en soins de santé primaires.
Méthodologie
Le Groupe d’étude canadien sur les soins de santé préventifs est un comité indépendant de cliniciens et méthodologistes qui formule des recommandations sur des interventions cliniques de prévention primaire et secondaire (https://canadiantaskforce.ca/?lang=fr). Un groupe de travail composé de 5 membres du Groupe d’étude canadien a rédigé cette ligne directrice avec le soutien scientifique de l’Agence de la santé publique du Canada.
Le cadre analytique utilisé pour la ligne directrice, y compris les questions clés, est accessible à l’annexe 1A. Nous avons sélectionné les issues cliniques jugées cruciales ou importantes par les patients (voir ci-dessous) ou par les membres du Groupe d’étude canadien pour orienter les revues systématiques et les recommandations. En fin de processus, 3 issues cliniques cruciales ont été retenues : mortalité de toute cause, mortalité par cancer et complications graves menaçant le pronostic vital ou médicalement significatives du dépistage; et 5 issues cliniques importantes: incidence de l’adénocarcinome œsophagien (par stade), qualité de vie, effets psychologiques, autres interventions médicales majeures et mineures, et surdiagnostic.
La recommandation de cette ligne directrice se fonde sur des revues systématiques concernant l’efficacité du dépistage33,35, sur les préférences et valeurs des patients34,35 et sur une synthèse des revues systématiques concernant l’efficacité des traitements35,47 que l’on peut tous consulter à l’adresse www.canadiantaskforce.ca/guidelines/published-guidelines/esophageal-adenocarcinoma/. Une analyse des résultats des groupes de discussion menés avec les patients50,57 a aussi documenté cette recommandation.
Le Centre d’analyse et de synthèse des données probantes de l’Institut de recherche de l’Hôpital d’Ottawa a procédé à 2 revues systématiques33–35 et à 1 synthèse des revues systématiques existantes35,47 entre septembre 2016 et juin 2018; des mises à jour de la recherche avant publication ont été menées en octobre33–35 et en novembre 201835,47. Les protocoles ont été inscrits au registre PROSPERO (CRD42017049993; CRD42017050014; CRD42018084825) et sont accessibles à l’adresse www.canadiantaskforce.ca/guidelines/published-guidelines/esophageal-adenocarcinoma/.31,32,58
Le Groupe d’étude canadien a utilisé l’approche GRADE (Grading of Recommendations, Assessment, Development and Evaluation) pour établir la certitude des données probantes et la force des recommandations (encadré no 1)37. L’annexe 1B explique le cadre de l’approche GRADE qui permet de passer des données probantes au libellé de cette recommandation, que le Groupe d’étude canadien complet a révisée et approuvée.
Participation des patients
Le Groupe d’étude canadien s’est adjoint la collaboration des patients pour la préparation de la ligne directrice. Le groupe chargé de l’application des connaissances à l’Hôpital St. Michael, de Toronto50,57 a mené cette collaboration en 2 étapes pour lesquelles on a recruté 17 hommes et femmes âgés de 18 ans ou plus atteints de RGO chronique. À l’étape 1, on a invité les participants à répondre à des questionnaires en ligne et à participer à des groupes de discussion téléphonique; ils ont fourni leur évaluation pour diverses issues cliniques du dépistage (bénéfices et préjudices). À l’étape 2, les participants ont été invités à revoir leur évaluation des issues cliniques après qu’on leur ait présenté une synthèse des données probantes provenant des revues systématiques.
Revue externe et par des experts de contenu
Des parties prenantes de l’extérieur et des experts de contenu du domaine clinique ont passé en revue les protocoles31,32, les revues systématiques33,34, la synthèse des revues systématiques47 et l’ébauche de la ligne directrice. Les experts de contenu du domaine clinique collaborent avec les membres du groupe de travail du Groupe d’étude canadien pour les aider à résoudre des problèmes techniques et à comprendre les enjeux cliniques importants, en participant aux réunions du groupe de travail, en vérifiant l’exactitude des principaux documents clés et en effectuant la révision de la version définitive de la ligne directrice. Ces experts ne font pas partie du Groupe d’étude canadien et ne votent pas sur les recommandations.
Gestion des intérêts concurrents
Le soutien financier du Groupe d’étude canadien sur les soins de santé préventifs provient de l’Agence de la santé publique du Canada. Les vues de l’organisme subventionnaire n’ont aucunement influé sur le contenu de la recommandation. Tous les membres du Groupe d’étude canadien ont eu à dévoiler tout conflit d’intérêts d’ordre financier ou autre. Les énoncés de conflits d’intérêts sont accessibles au public sur le site Web du Groupe d’étude canadien. Un membre du Groupe d’étude canadien (H.S.) a déclaré être gastroentérologue et effectuer des endoscopies dans le cadre de sa pratique clinique; il a participé à titre de membre sans droit de vote au groupe de travail. Les autres membres de Groupe d’étude canadien ont tous déclaré ne pas être en situation de conflit d’intérêts en ce qui concerne cette ligne directrice.
Les experts de contenu du domaine clinique doivent dévoiler tout conflit d’intérêts dès le début de leur participation et annuellement par la suite. Un expert a déclaré un conflit d’intérêts en lien avec une recherche soutenue en partie par des fonds industriels. Conformément au manuel des procédures du Groupe d’étude canadien, la direction de ce dernier a révisé cette déclaration. Il a été déterminé que le conflit d’intérêts déclaré était sans lien avec la présente ligne directrice et qu’il n’aurait aucun effet prévisible sur la transparence, l’intégrité et l’acceptabilité de la ligne directrice.
Mise en œuvre
Les cliniciens devraient être à l’affût des symptômes d’alarme d’un adénocarcinome œsophagien et évaluer, orienter et prendre en charge leurs patients en conséquence. Ils devraient aussi faire preuve de jugement clinique lorsqu’il est question d’épreuves diagnostiques et de prise en charge des patients réfractaires au traitement du RGO ou présentant des symptômes évocateurs d’un autre problème des voies digestives hautes (p. ex., dyspepsie).
Suivi et évaluation
Le degré de connaissances des cliniciens au sujet d’une recommandation est un indicateur de son adoption dans la pratique. Les taux d’endoscopie de dépistage pourraient aussi être suivis pour mesurer l’adoption de la recommandation. Le Groupe d’étude canadien suivra la publication de nouvelles données probantes et le cas échéant, mettra la recommandation à jour s’il appert qu’elles peuvent influer sur son orientation ou sa solidité.
Autres lignes directrices
L’Association canadienne de gastroentérologie, la British Society of Gastroenterology et l’American Gastroenterological Association recommandent toutes de ne pas faire de dépistage systématique chez les patients non sélectionnés qui souffrent de RGO chronique4,59,60. Certaines lignes directrices4,5,60–62 suggèrent le dépistage chez les patients atteints de RGO qui présentent de multiples facteurs de risque (tableau 3). Ces recommandations ne reposent pas sur des études concernant le dépistage, mais utilisent plutôt des données épidémiologiques qui montrent une corrélation entre certains facteurs de risque spécifiques (p. ex., âge élevé [≥ 50 ans], sexe masculin, obésité abdominale) et le développement d’un œsophage de Barrett ou d’un adénocarcinome œsophagien4–10. Certaines lignes directrices ont aussi intégré des études de modélisation économique5,62,63 ou l’opinion d’experts4 en plus de l’analyse des facteurs de risque. En outre, des études de cohorte sur l’œsophage de Barrett montrent que le suivi pourrait offrir un léger bénéfice sur le plan de la survie64–69. Toutefois, ce bénéfice pourrait surtout être le reflet d’un biais de devancement; nous avons exclu de notre ligne directrice les patients qui avaient déjà un diagnostic d’œsophage de Barrett.
Recommandations nationales et internationales sur le dépistage de l’adénocarcinome œsophagien, de l’œsophage de Barrett ou de la dysplasie
Lacunes dans les connaissances
L’usage limité d’une définition commune du RGO chronique (p. ex., gravité, durée, traitement médicamenteux), réduit la généralisabilité des études existantes. Idéalement, il faudrait disposer d’ERC bien conçus sur les effets du dépistage par rapport à l’absence de dépistage chez les patients atteints de RGO chronique. Les obstacles à la faisabilité, toutefois, incluent la faible prévalence de l’adénocarcinome œsophagien et la probabilité limitée que les patients qui souffrent de RGO évoluent vers un cancer. On a besoin de recherches visant à évaluer des techniques de dépistage moins invasives et moins coûteuses en termes de ressources (p. ex., le dispositif Cytosponge ou d’autres dispositifs avalés)70,71 ou à clarifier l’efficacité des traitements. Par exemple, un récent ERC (n = 2557) a fait état d’une amélioration au fil du temps de la mortalité de toute cause, de l’adénocarcinome œsophagien ou de la dysplasie de haut grade chez des cas d’œsophage de Barrett traités par une association d’inhibiteurs de la pompe à protons à dose élevée et d’acide acétylsalicylique72. Par contre, cet ERC ne répondait pas à nos critères d’inclusion47 puisqu’il n’a pas encore été intégré à une revue systématique. Des formes plus récentes de traitement chirurgical (p. ex., combinaison de résection muqueuse endoscopique et ablation par radiofréquence, et dissection sous-muqueuse endoscopique) méritent également d’être évaluées.
Conclusion
Les données probantes passées en revue pour cette ligne directrice n’ont pas révélé de bénéfices cliniquement significatifs associés au dépistage de l’adénocarcinome œsophagien ou de ses précurseurs chez les adultes atteints de RGO chronique. Elles n’ont pas non plus fourni suffisamment de données dans les différentes catégories de facteurs de risque (p. ex., âge élevé [≥ 50 ans], sexe masculin, obésité abdominale) pour appuyer la modification de notre recommandation quant au dépistage en fonction de ces facteurs, seuls ou en combinaison. Le Groupe d’étude canadien recommande fortement aux cliniciens de ne pas offrir de dépistage aux adultes qui souffrent de RGO chronique. Cette ligne directrice ne s’applique pas aux personnes qui manifestent des symptômes d’alarme ni à celles qui ont déjà un diagnostic d’œsophage de Barrett (avec ou sans dysplasie), qui devraient être évaluées, orientées et prises en charge en conséquence.
Remerciements
Les auteurs remercient l’équipe du Centre d’analyse et de synthèse des données de l’Institut de recherche de l’Hôpital d’Ottawa (IRHO) (Candyce Hamel, Andrew Beck, Nadera Ahmadzai, Micere Thuku, Kusala Pussegoda, Adrienne Stevens, Becky Skidmore, Avijit Chatterjee, Donna E. Maziak, Kristopher Dennis, Lise Bjerre, Lorenzo Ferri, Beverley Shea, Brian Hutton, Julian Little et David Moher) pour les revues des données probantes qui sous-tendent cette ligne directrice; Marc Avey, Susan Courage, Bradley Mitchelmore et Rachel Rodin de la Division des lignes directrices et de la santé mondiale de l’Agence de la santé publique du Canada, qui ont appuyé la préparation de la ligne directrice; et le Programme d’application des connaissances de l’Institut du savoir Li Ka Shing de l’Hôpital St. Michael pour sa contribution à l’engagement des patients et à l’application des connaissances en lien avec cette ligne directrice. Ils remercient aussi Paul J. Belletrutti, de l’Université de Calgary, Calgary, Alta., et Laura Targownik, de l’Université du Manitoba, Winnipeg, Man., pour leur aide en tant qu’experts de contenu du domaine clinique pendant la préparation de cette ligne directrice. Les experts de contenu du domaine clinique qui ont aidé le Groupe d’étude canadien durant le processus d’élaboration de la ligne directrice peuvent être d’accord ou non avec les recommandations du Groupe d’étude canadien. Les auteurs sont aussi reconnaissants envers les pairs-réviseurs et les parties prenantes organisationnelles qui ont formulé des commentaires sur l’ébauche de la ligne directrice, notamment David Armstrong, Université McMaster, Hamilton, Ont.; Shawn Chirrey, Société canadienne du cancer, Toronto, Ont.; Bruce Greenwald, Faculté de médecine de l’Université du Maryland, Baltimore (Md.); Milli Gupta, Université de Calgary, Calgary, Alta.; Prasad G. Iyer, Clinique Mayo, Rochester (Minn.); Edward Kucharski, Université de Toronto, Toronto, Ont.; Grigorios Leontiadis, Université McMaster, Hamilton, Ont., et Gilles Plourde, Santé Canada, Ottawa, Ont.
Footnotes
Entrevue avec l’auteur en baladodiffusion : https://soundcloud.com/cmajpodcasts/190814-guide-fre
Voir le commentaire connexe (en anglais) au www.cmaj.ca/lookup/doi/10.1503/cmaj.200697
Intérêts concurrents: Harminder Singh a déclaré être gastroentérologue et effectuer des endoscopies dans le cadre de sa pratique clinique. Le Dr Singh signale aussi avoir reçu des honoraires personnels de Takeda Canada, Pendopharm et Amgen, à l’extérieur des travaux soumis. Aucun autre intérêt concurrent n’a été déclaré.
Cet article a été révisé par des pairs.
Comité de rédaction de la ligne directrice: Stéphane Groulx (membre du Groupe d’étude canadien ayant droit de vote), Heather Limburg (membre de l’équipe scientifique sans droit de vote), Marion Doull (membre de l’équipe scientifique sans droit de vote), Scott Klarenbach (membre du Groupe d’étude canadien ayant droit de vote), Harminder Singh (membre du Groupe d’étude canadien sans droit de vote), Brenda J. Wilson (membre du Groupe d’étude canadien ayant droit de vote), Brett Thombs (membre du Groupe d’étude canadien ayant droit de vote)
Membres collaborateurs du Groupe d’étude canadien sur les soins de santé préventifs: Ahmed Abou-Setta, Heather Colquhoun, Roland Grad, Michael Kidd, Christina Korownyk, Eddy Lang, John C. LeBlanc, Gabriela A. Lewin (ex-membre), Ainsley Moore, Nav Persaud, Donna L. Reynolds, John J. Riva, Guylène Thériault
Collaborateurs: Stéphane Groulx, Heather Limburg, Marion Doull, Scott Klarenbach, Harminder Singh, Brenda Wilson et Brett Thombs ont contribué substantiellement à la conception et à l’élaboration de l’étude, à l’interprétation des données probantes et à la révision critique de l’ébauche de la ligne directrice. Heather Limburg et Marion Doull ont fourni un soutien scientifique et logistique au comité de rédaction. Stéphane Groulx, Scott Klarenbach, Harminder Singh, Brenda Wilson et Brett Thombs ont rédigé l’ébauche des recommandations. Stéphane Groulx, Heather Limburg et Marion Doull ont rédigé le libellé de la ligne directrice. Tous les auteurs cités ont donné leur approbation finale à la version de la ligne directrice destinée à être publiée et se portent garants de tous les aspects du travail. Tous les membres collaborateurs du Groupe d’étude canadien sur les soins de santé préventifs (Ahmed Abou-Setta, Heather Colquhoun, Roland Grad, Michael Kidd, Christina Korownyk, Eddy Lang, John LeBlanc, Gabriela Lewin [ex-membre], Ainsley Moore, Nav Persaud, Donna L. Reynolds, John Riva et Guylène Thériault) ont aussi contribué à la préparation de la ligne directrice et ont donné leur approbation finale pour la version de la ligne directrice devant être publiée.
Financement: Le financement du Groupe d’étude canadien sur les soins de santé préventifs est fourni par l’Agence de la santé publique du Canada. Les vues de l’organisme subventionnaire n’entrent pas en ligne de compte lorsque le Groupe d’étude canadien prépare ses recommandations. Les vues exprimées aux présentes n’engagent que le Groupe d’étude canadien et ne représentent pas nécessairement celles de l’Agence de la santé publique du Canada.